Федеральный исследовательский центр химической
физики им. Н.Н. Семёнова Российской Академии Наук
Центр коллективного пользования (ЦКП)
Анализ химических, биологических систем и природных материалов: масс-спектральная микроскопия и фемтосекундная лазерная микроскопия-спектроскопия (АНХИБИС)
Данное направление исследований представлено несколькими разновидностями масс-спектрометрии: времяпролетной масс-спектрометрии вторичных ионов (time-of-flight secondary ion mass spectrometry, ToF-SIMS), масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС, ICP-MS), масс-спектрометрии ионно-циклотронного резонанса (ICR-MS), времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией (Matrix Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry, MALDI-ToF MS).
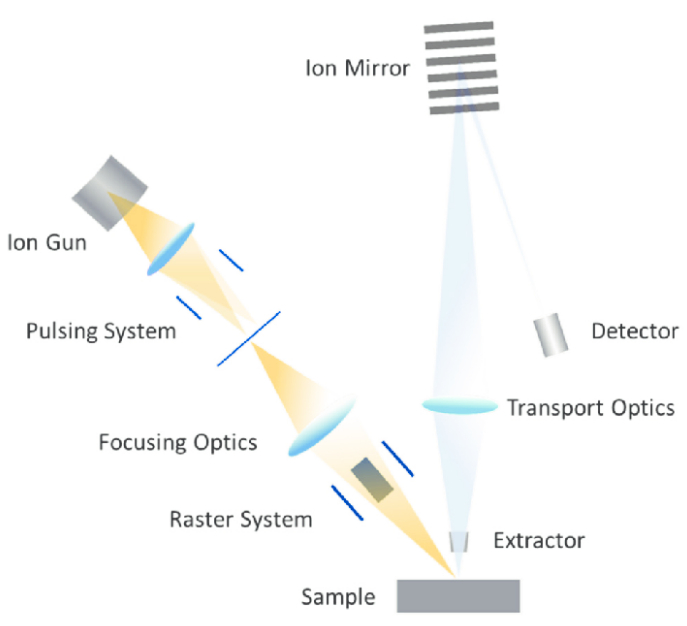
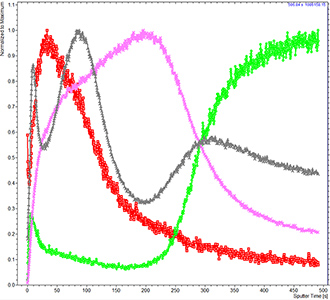
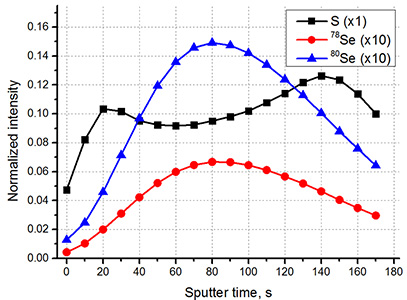
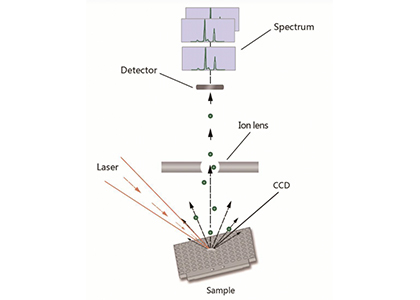
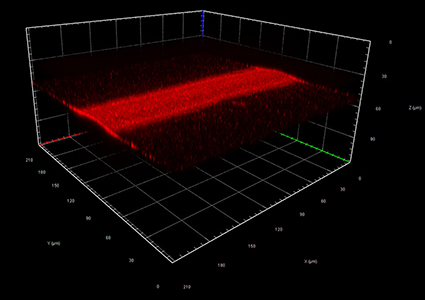
ToF-SIMS - чувствительный аналитический метод для исследования химического состава поверхности, а при дополнительном снятии поверхностных слоев образца для исследования состава объемного образца. Достоинство ToF-SIMS состоит в возможности проведения экспресс-анализа химического состава при нанометровом (до 80 нм) пространственном разрешении на исследуемой поверхности. Кроме этого, метод обеспечивает разрешение по глубине анализа до 10-20 нм. Сочетание таких характеристик может позволить определять состав и распределение химических компонент в образце и получать 3D изображение распределения химического состава объекта. Таким образом, TOF-SIMS можно использовать как масс-спектральный микроскоп для получения 2D и 3D ионных изображений.
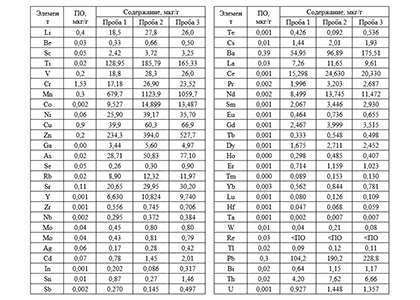
ICP-MS – высокочувствительный аналитический метод для определения концентрации металлов и некоторых неметаллов (кроме: H, He, C, N, O, F, Ne, Cl, Ar, Kr, Xe) в растворах с концентрацией элементов от долей ppb. ICP-MS позволяет определять содержание металлов в диапазоне m/z от 2 до 260 а.е.м. с разрешением 0,4–0,8 а.е.м. Преимуществом метода является возможность определять содержание металлов вплоть до концентраций ~ 0,1 мг/кг. Измерения могут быть проведены только для образцов в жидкой фазе, поэтому для анализа состава исследуемых материалов (напр. грунтов) необходима экстракция металлов в жидкую фазу. Возможно исследование готовых жидких образцов, концентрированных образцов, твердых образцов (после предварительного растворения).
MALDI-ToF MS используется в микробиологических клинических лабораториях для идентификации патогенных бактерий, особенно микроаэробов, анаэробов, микобактерий и грибов, благодаря имеющейся базе данных (в 2022 году база данных включала в себя 1032 рода, 5053 вида, 16892 штамма микроорганизмов) и производительности (получение бактериального спектра в течение нескольких минут). MALDI-ToF представляет собой технологию мягкой ионизации исследуемого вещества, в результате которой образуются однозарядные ионы. Это способствует максимальному сохранению структуры вещества. Масс-спектрометры по технологии MALDI-ToF (в т.ч. серии Autof MS) состоят из двух модулей: MALDI (источник ионов) и ToF (время-пролетный анализатор). Специальная матрица поглощает энергию импульса лазера и передает ее биологическим молекулам в составе образца. Ионизация биомолекул происходит путем передачи протона или получения протона. В оборудовании используется длина волны лазера 337 нм (азотный лазер), диапазон измеряемых масс составляет от 1 до 500 кДа.
Основными конкретными научно-техническими задачами данного направления являются:- Масс-спектральная 2D и 3D визуализация химического состава в полимерах, сплавах, композитных материалах, минералах (ToF-SIMS);
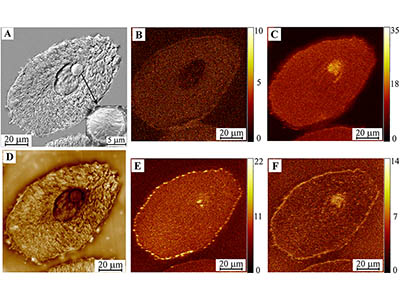
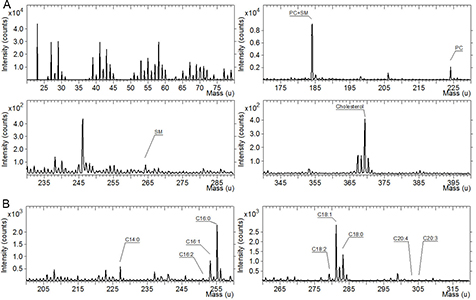
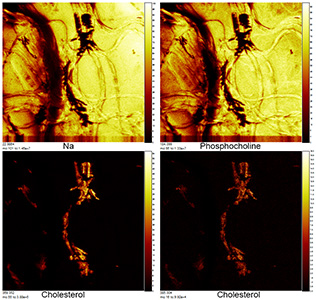
- Масс-спектральная 2D и 3D визуализация химического состава в прошедших пробо-подготовку биологических образцах (ToF-SIMS): клеточных культурах (в т.ч. раковых), срезах тканей (печени, мозга, крупных клетках). Изучение липидного состава биологических объектов. Изучение распределения веществ и лекарственных препаратов, содержащих специфические атомы (напр., противораковые преппараты с содержанием металлов).
- Количественный анализ на содержание элементов образцов в жидкой и твердых фазах (ICP-MS);
- Идентификация микроорганизмов (MALDI-ToF): грамотрицательных и грамположительных бактерий, грибов;
На базе данного метода предоставляются следующие услуги:
- Получение масс-спектров твердых и порошковых образцов;
- Получение масс-спектров образцов в замороженном состоянии;
- Химическое картирование (имиджинг) образцов, в чатсноти, в замороженном состоянии;
- Профилирование по глубине сложных полимерных, диэлектрических и биологических образцов;
- 3D имиджинг (химическое картирование) образцов.
- Количественный ICP-MS анализ на содержание элементов в образцах.
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Времяпролетный масс-спектрометр вторичных ионов TOF-SIMS 5, оснащенный Bi-Mn эмиттером первичных ионов и вспомогательными ионными источниками Cs+ и O2- для ионного травления. Аргоновый кластерный эмиттер (2022 год). | ION-TOF | 2011 |
| ● | Масс-спектрометр с индуктивно связанной плазмой Supec 7000 | Focused Photonics | 2022 |
| ● | Спектрометр MALDI-TOF Autof MS series | Autobio | 2023 |
В данном направлении исследований - структурных, морфологических, поверхностных, деформационных и размерных характеристик используются методики и подходы сканирующей растровой электронной микроскопии (SEM), ЭПР спектроскопии, рентгеновской дифракции (XRD) и рентгеновского зондирования, сдвиговой реологии, атомно-силовой микроскопии (АСМ, AFM), стилусной профилометрии, методик динамического рассеяния света (ДРС, DLS).
SEM позволяет проводить изучение структуры и морфологии образца в режимах топографического и композиционного контраста с пространственным разрешением до 3 нм. Для анализа могут быть использованы образцы, допускающие проведение исследований в условиях вакуума (10-4 Па). Помимо этого доступно химическое картирование методом энергодисперсионной рентгеновской спектроскопии (EDS), а также измерение катодолюминесценции образца.
Универсальный многоцелевой рентгеновский дифрактометр (XRD) с вертикальным гониометром радиусом 300 мм и горизонтальным расположением образца позволяет количественно и качественно анализировать фазовый состав твёрдых тел (как порошков, так и объёмных, с шероховатой или гладкой поверхностью) и тонких плёнок. Прибор имеет следующие особенности: 1) Керамическая рентгеновская трубка с Cu анодом и острым фокусом, 2.2 кВт; 2) Плоское зеркало для монохроматизации первичного пучка, расходящийся пучок для съемки в геометрии Брэгга-Брентано; 3) Быстрый позиционно-чувствительный полупроводниковый одномерный детектор с динамическим диапазоном более 108имп/сек (512 пикселей в ряд, размер пикселя 75 мкм); 4) Возможность установки собственных приставок (SAX и пр.).
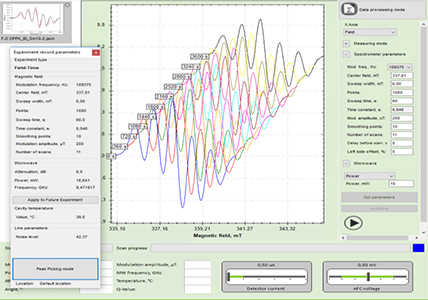
ЭПР спектрометр предназначен для исследования структуры и динамики веществ и материалов, в том числе, нано-структурированных, изучения кинетики радикальных процессов, установления молекулярного строения органических радикалов и комплексов переходных металлов. Основные параметры ЭПР спектрометра: чувствительность 5х1010 спин/мТл; диапазон рабочих частот 9,20 ÷ 9,55 ГГц; диапазон индукции магнитного поля от 0,01 Тл до 0,7 Тл; частота модуляции магнитного поля от 10 кГц до 250 кГц; мощность СВЧ генератора 150 мВт; температурный диапазон измерений от -170 0 С до +200 град.
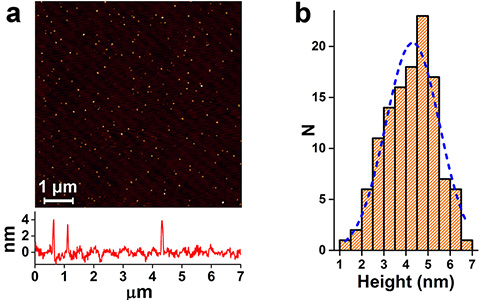
Атомно-силовая микроскопия является разновидностью зондовой микроскопии для анализа поверхности на атомно-молекулярном уровне. На расстоянии около одного ангстрема между зондом и атомами образца возникают силы отталкивания, а на больших расстояниях - силы притяжения. Кантилевер (с прикрепленным зондом), перемещается относительно поверхности и реагирует на силовое взаимодействие, регистрируя рельеф поверхности образца. В зависимости от типа взаимодействия между зондом и поверхностью AFM может работать в одном из нескольких режимов: контактный режим (contact mode); бесконтактный режим (non-contact mode); полуконтактный режим (tapping mode).
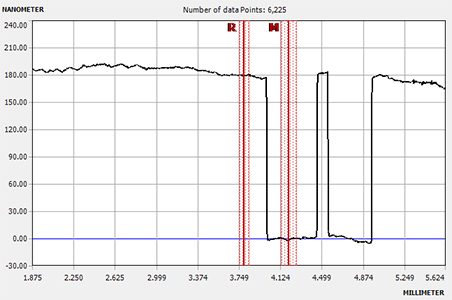
Стилусный профилометр (Alpha-Step D-500, KLA) позволяет проводить двухмерные измерения высоты ступени, шероховатости и кривизны поверхности. Использование оптического сенсора обеспечивает измерения с высоким разрешением, большой вертикальный диапазон (от нанометров до 1200 мкм) и возможность измерения легкодеформируемых образцов с малым давлением на стилус. Преимущество метода стилусной профилометрии заключается в том, что это прямое измерение, независимое от свойств материала. Регулируемое усилие и выбор стилуса позволяют проводить точные измерения самых разных структур и материалов. Это позволяет количественно оценить ваш процесс, чтобы определить количество добавленного или удаленного материала, а также любые изменения в структуре путем измерения шероховатости и напряжения.
DLS используется в лазерной корреляционной спектроскопии для определения размеров частиц в суспензии. Принцип измерения основан на броуновском движении частиц: скорость диффузии броуновского движения обратно пропорциональна размеру (гидродинамическому диаметру) частиц. Таким образом измеряемая флуктуация рассеянного сигнала во времени связана с флуктуацией количества частиц в измеряемом объеме, разные частоты флуктуации дают информацию о дисперсии частиц в суспензии. Оборудование позволяет проводить измерение распределения размер частиц от нескольких нм до сотен мкм. С помощью специальных погружных зондов также возможно измерение химического потенциала частиц в растворе.
По данному направлению исследований возможны следующие работы:- Получение изображений топографических особенностей образа в вторичных электронах (SE) с разными увеличениями. Услуга включает установку и дегазацию образца, а также получения серии вторично-электронных изображений (с одного места) с разными увеличениями (от 50-100х до 35000-100000x в зависимости от условий).
- Получение изображений композиционных и топографических особенностей образца в обратно-отраженных электронах (BSE) с разными увеличениями;
- Энергодисперсионная рентгеновская спектроскопия (EDS / EDX);
- Катодолюминесценция: получения серии катодолюминесценых изображений (с одного места) с разными увеличениями;
- Подготовка непроводящих образцов к анализу в условиях высокого вакуума: напыление слоя металла или углерода. (Используется для SEM);
- Изображения в режиме среды (ESEM): получение серии изображении во вторичных или обратно-отраженных электронах для диэлектрических образцов в условиях среды (давление свыше 100 Па).
- Обнаружение парамагнитных соединений (веществ, имеющих неспаренные электроны) – соединений переходных металлов, органических радикалов, дефектов в кристаллических матрицах. Определение концентрации парамагнитного вещества в образце. Получение информации о природе дефекта или структуре парамагнитной молекулы. (ЭПР);
- Изучение непарамагнитных систем и материалов методом спинового зонда, который заключается во введении в образцы небольшого количества стабильных парамагнитных молекул с известными свойствами и наблюдении за их поведением (подвижность, ориентация, полярность локального окружения и т.д.). Имеется большой набор нитроксильных спиновых зондов различной структуры, в том числе, рН-чувствительных. (ЭПР);
- Регистрация температурных зависимостей спектров ЭПР с целью изучения изменений системы при изменении температуры;
- Регистрация угловых зависимостей спектров ЭПР для изучения ориентационно упорядоченных образцов (жидкие кристаллы, деформированные полимеры, мембраны, и т.д.);
- XRD дифрактограммы порошкообразных образцов, объёмных образцов с выровненной или шероховатой поверхностью, тонких плёнок под скользящим пучком;
- Качественный и количественный анализ XRD дифрактограмм используя базы данных;
- Получение атомно-силовых (AFM) изображений поверхности образца и анализ распределения размеров наночастиц, высаженных на твердую подложку в диапазоне размеров частиц 1-500 нм;
- Получение профилей топографических особенностей поверхности образца и оценка шероховатости поверхности образца методом стилусной профилометрии (RMS);
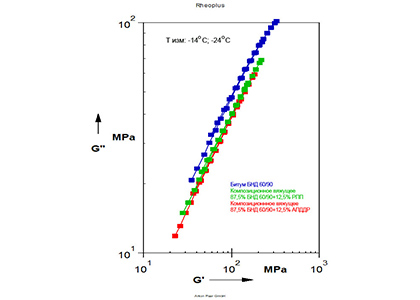
- Оценка сдвиговой устойчивости битумного вяжущего путем осцилляционной деформации образца и определения значений комплексного модуля сдвига и фазового угла (реология);
- Исследование низкотемпературных свойств битумного вяжущего путем определения комплексного модуля сдвига и фазового угла при деформации 0,1%, в диапазоне частот от 0,1 до 250 рад/с при температуре не ниже -28 град. (реология);
- Измерение размера нано/субмикро частиц в растворах, химического потенциала частиц (DLS).
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Растровый электронный микроскоп Prisma E (SEM) | ThermoFisher Scientific | 2020 |
| ● | Установка для напыления золота и углерода Q150R (для SEM-исследований диэлектрических образцов с максимальным разрешением в условиях высокого вакуума) | Quorum | 2020 |
| ● | Порошковый рентгеновский дифрактометр Rigaku Smartlab SE | Rigaku | 2021 |
| ● | ЭПР спектрометр SPINSCAN X | АДАНИ | 2022 |
| ● | Реометр динамического сдвига "MCR SmartPave 101" | Anton Paar | 2011 |
| ● | Атомно-силовая сканирующий модуль SMENA-A со сменными кантилеверами и сканирующая пьезоплатформа. Атомно-силовой модуль может работать в контактном, полуконтактном и бесконтактном режимах, доступны методики измерения топографии, силы трения, магнитных и электрических сил, фазового контраста. | NT-MDT | 2004 |
| ● | Стилусный профилометр Alpha-Step D-500 | KLA | 2021 |
| ● | Лазерный анализатор размера частиц "Analyzette-22" | Fritsch | 2011 (Имеется свидетельство о поверке) |
| ● | Многоугловой анализатор размеров частиц с функцией измерения дзета-потенциала Photocor Complex | Photocor | 2022 |
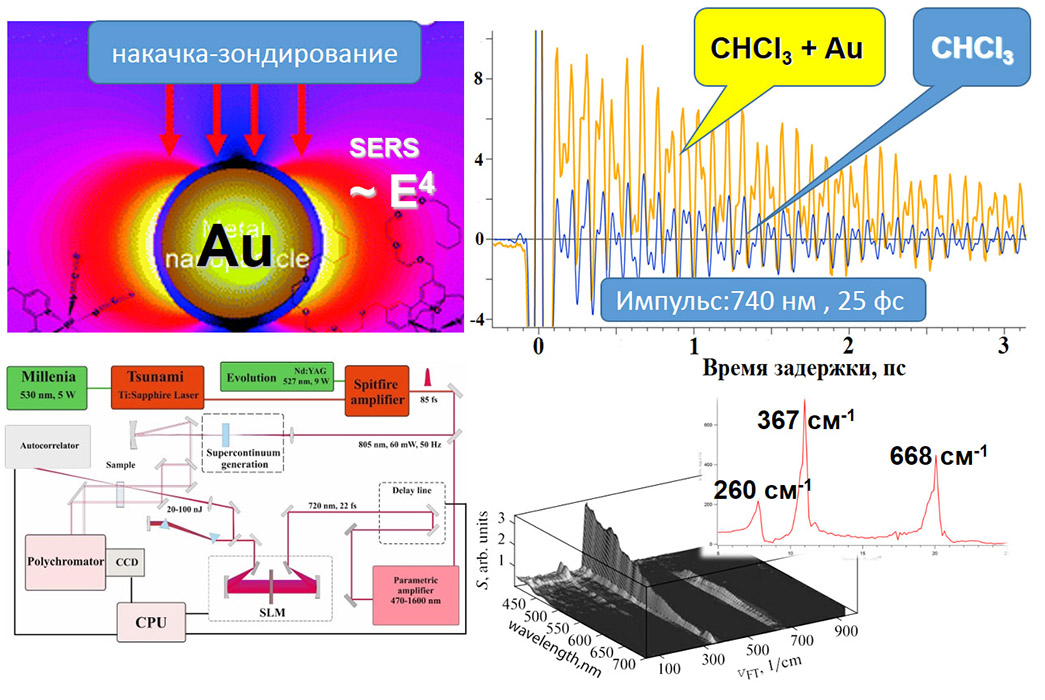
Получение колебательных спектров различных веществ в данном направлении осуществляется методами ИК-Фурье (FTIR) спектроскопии и микроспектроскопии (с пространственным разрешением порядка длины волны среднего ИК диапазона), а также методами микроспектроскопии комбинационного рассеяния света (рамановское рассеяние света). Методики линейного спонтанного (а также в отдельных случаях, которые зависят от свойств образцов - резонансное рассеяние и рассеяние усиленное поверхностными эффектами - SERS) используют монохроматические источники с длинами волн УФ (359 нм), видимого (457, 532, 640 нм) и ближнего ИК (785 и 1064 нм) диапазонов.
Высоко-автоматизированный FTIR (Lumos, Bruker) микроскектрометр позволяет детектировать колебательные полосы различных материалов в диапазоне от 450 до 7800 см-1 с разрешением не хуже 2 см-1. Детектор MCT, охлаждаемый жидким азотом, обеспечивает высокие параметры чувствительности и соотношения сигнал/шум (до 35000:1) проводимых измерений. Прибор позволяет анализировать отдельные заданные области образцов, а также проводить сканирование с высоким пространственным разрешением (~1.25 микрон) в режиме полноного внутреннего отражения (ATR). Спектрометр (Vertex, Bruker) также обладает возможностью снимать спектры в режиме ATR, однако площадка на которой происходит "усреднение" на два порядка больше, поэтому в задачах где не стоит вопрос исследовать неоднородность образцов на микромасштабе использование Vertex предпочтительнее.
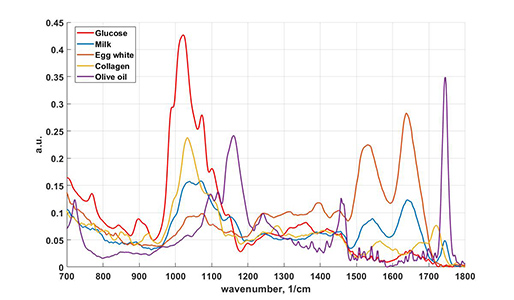
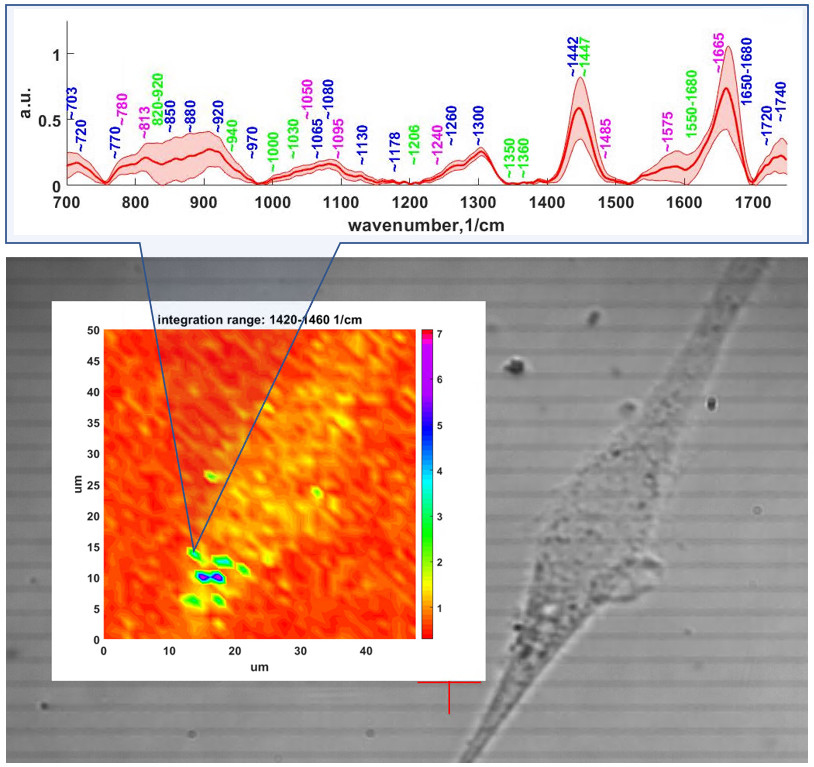
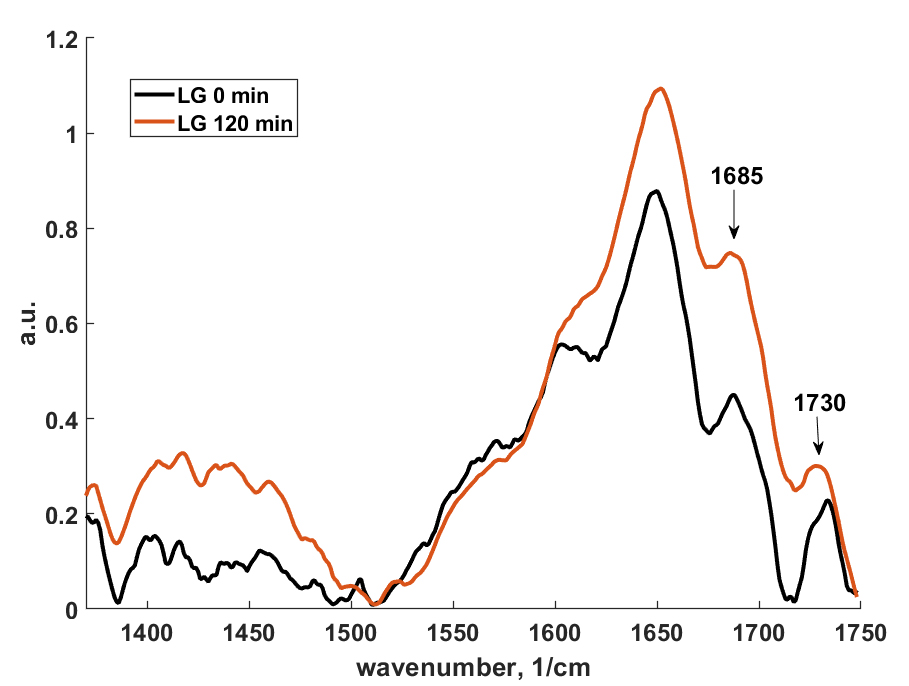
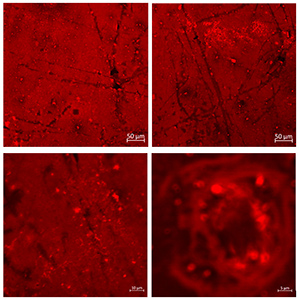
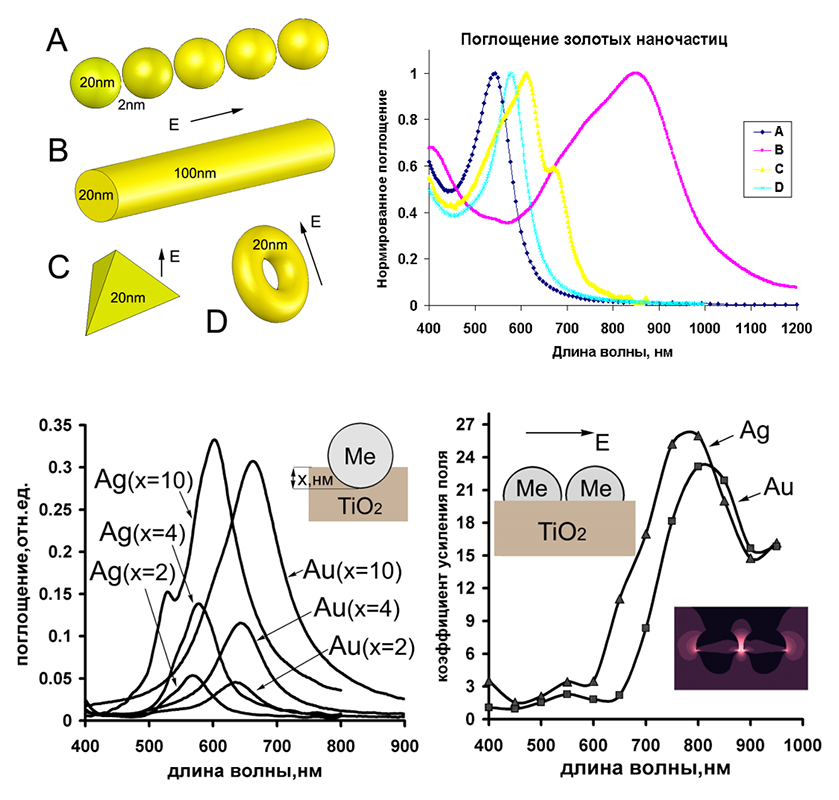
Линейная спектроскопия/микроспектроскопия комбинационного представлена как в виде коммерческих приборов (785 нм, Senterra, Bruker), (532, 1064 нм, Фотон-Био), так и в виде исследовательских лабораторных систем (360 нм, 457 нм, 532 нм, 640 нм, 785 нм, 1064 нм), которые позволяют проводить очень гибкую подстройку мощности возбуждения, параметров экспозиции охлаждаемого детектора (вплоть до единиц мс), наблюдения сигнала в антистоксовом режиме, проводить сбор сигнала как в поточечном режиме так и при непрерывном усредняющем движении моторизированных подвижек. Объекты исследования и задачи: полимеры, композитные материалы, природных минералы, битумы, биологические образцы (ткани, срезы), пигмент-белковые системы, фотонные моды квантовых точек, усиление сигнала плазмонными золотыми и серебряными наноструктурами (SERS, SE-CARS) – для каждой морфологии наноструктур может быть использована длина волны возбуждения, дающая наибольшие коэффициенты усиления сигнала.
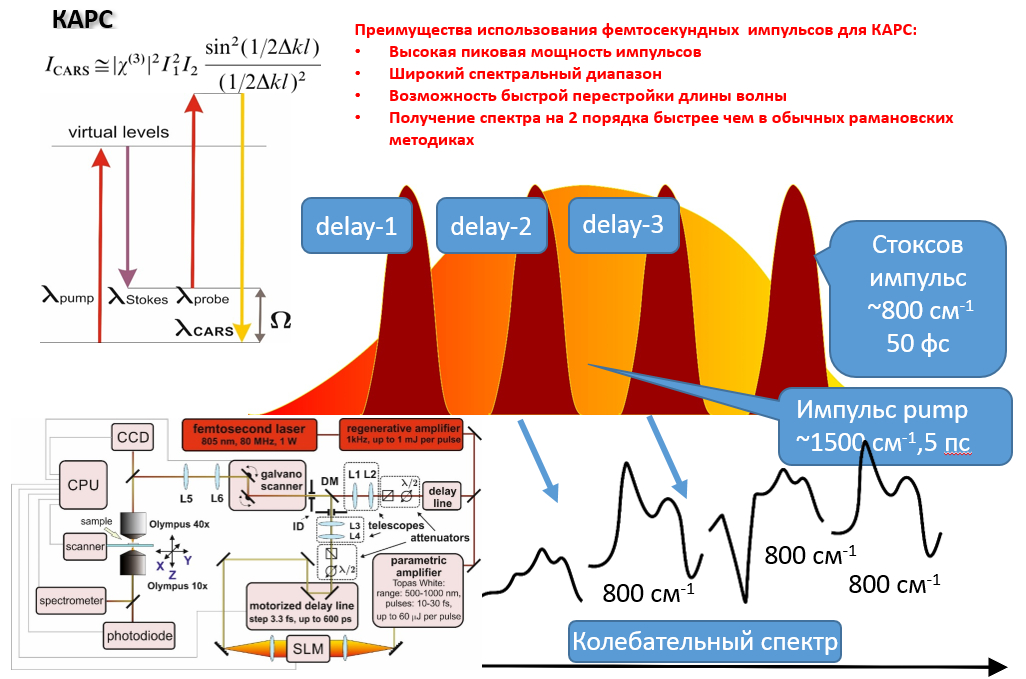
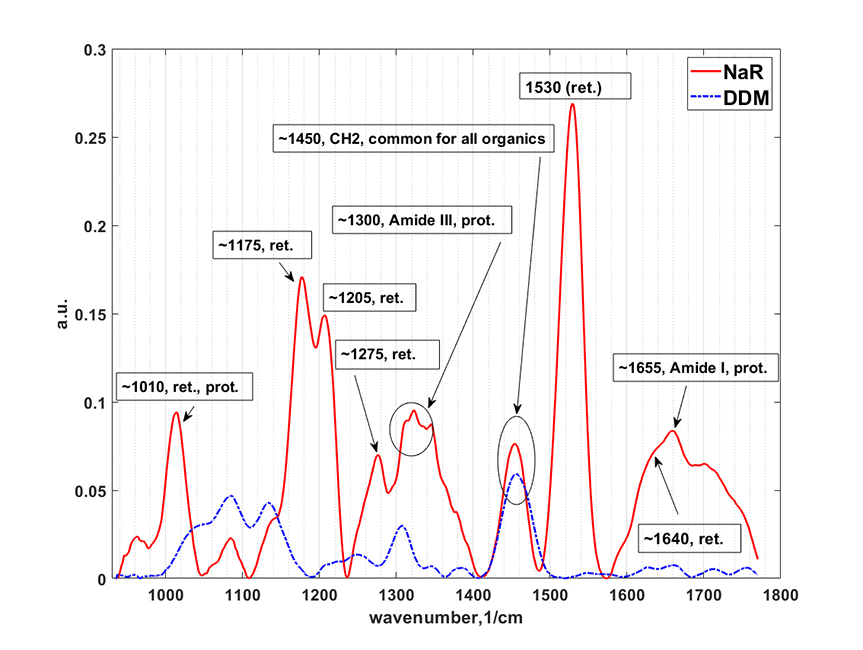
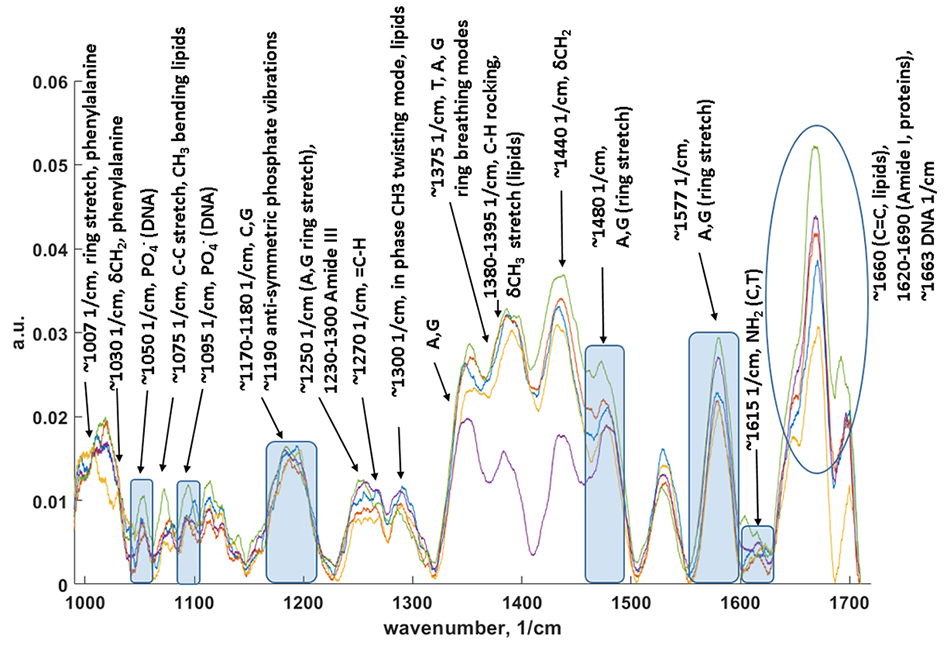
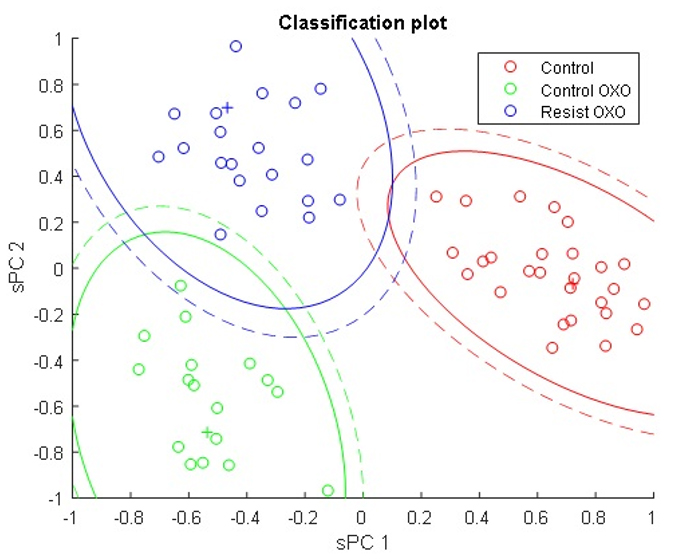
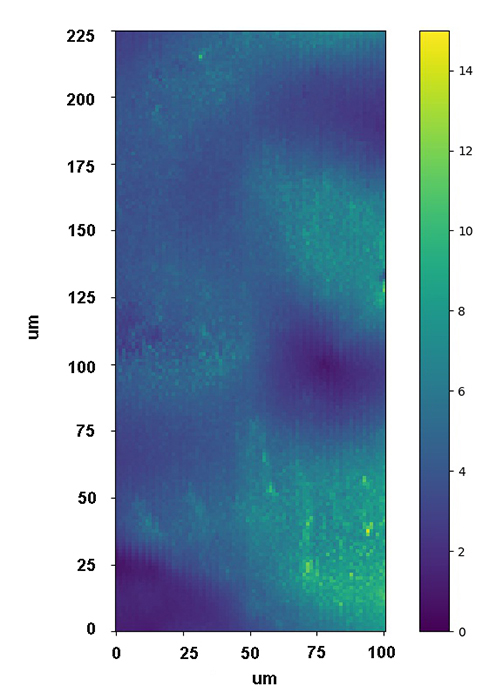
В данном направлении также используются современные подходы нелинейной рамановской спектроскопии. Специфика фемтосекундных лазерных импульсов заключается в их высокой пиковой интенсивности (I) и большой спектральной ширине (~1/tau). Первое обстоятельство позволяет эффективно наблюдать нелинейные оптические процессы, в т.ч. высоконаправленные когерентные процессы рамановского рассеяния: CARS (Coherent anti-Stokes Raman scattering, ~I3, SRS (Stimulated Raman scattering, ~I2). Второе обстоятельство позволяет единовременно получать спектральный диапазон колебательных частот образца шириной в сотни обратных сантиметров. По сравнению с традиционными рамановскими микроскопами использование созданного в ФИЦ ХФ РАН уникального фемтосекундного микроспектрометра имеет преимущества для следующих задач: 1) В задачах где необходимо иметь максимально возможное пространственное разрешение при сканировании образца (до 200 нм). Такое разрешение достигается за счет нелинейности генерируемых оптических процессов в исследуемом образце; 2) В задачах где определение рамановских частот в стоксовой области сильно затруднено. В этом случае в фемтосекундном микроспектрометре сигнал собирается из антистоксовой области (CARS), свободной от люминесценции образца; 3) В задачах где необходимо максимально быстрое 2D/3D картирование в узком диапазоне колебательных частот (~10 см-1). Увеличение скорости сканирования до 3х порядков достигается за счет использования быстрых гальванических зеркал и ФЭУ. Данная конфигурация особенно подходит для тех образцов где нежелательны механические перемещения исследуемого образца. Для образцов с низкими концентрациями веществ или слабыми интенсивностями рамановских линий может быть использована спектральная фокусировка лазерных импульсов. А этом случае, сканируемый интервал колебательных частот может быть уменьшен до 2-3 1см-1; 4) В задачах где необходимо быстрое 2D/3D картирование заданного диапазона колебательных частот (шириной до 1200 1/см) со спектральным разрешением 10 1/см. Скорость сканирования в значительно выше чем в традиционных рамановских микроскопах. Данный нелинейной микроспектроскопии направлена на проведение исследований в: 1) Растворах химических соединений: GFP белках, родопсинах, ксантофиллах, липидно-белковых смесях, пигмент-белковых комплексах (в т.ч. хлорофилл содержащих), оммохромах тканей беспозвоночных; 2) Клеточных культурах, срезах тканей животных и человека (печени, мозга, жировой ткани, липидные капли, липофусциновые гранулы); 3) Живых биологических объектах: ооцитах, сперматозоидах, стволовых клетках.
Услуги по данной методике в себя включают:
- Концентрирование растворов для измерения колебательных спектров неиспаряемых остатков (FTIR, комбинационное рассеяние);
- Измерение ИК-Фурье спектров на спектрометрах и микроспектрометрах
- Измерение колебательных спектров при возбуждении на длине волны 532, 785 и 1064 нм (коммерческие микроспектрометры);
- Измерение колебательных спектров при возбуждении на длинах волн 360 нм, 457 нм, 532 нм, 640 нм (исследовательская установка); В т.ч. измерение колебательных спектров при автоматическом сканировании разного типа. Возможно проведение экспериментов при отрицательных (до 77 К) и положительных температурах (десятки градусов).
- Обработка и анализ спектров комбинационного рассеяния материалов.
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | ИК-Фурье микроcgtrnhjvtnh LUMOS-II | Bruker | 2021 |
| ● | ИК-Фурье спектрометр Vertex 70 | Bruker | 2010 |
| ● | Микроспектрометр комбинационного рассеяния Senterra (785 нм) | Bruker | 2010 |
| ● | Микроспектрометр комбинационного рассеяния (532, 1064 нм) | Фотон-Био | 2023 |
| ● | Монохроматические лазеры | CNI | 2021-2024 |
| ● | Лазер непрерывный твердотельный с диодной накачкой Millennia pro 5sJ | Spectra-Physics | 2007 |
| ● | Фемтосекундный лазер Tsunami 3060 | Spectra-Physics | 2003 |
| ● | Лазер импульсный твердотельный с диодной накачкой Empower. | Spectra-Physics | 2007 |
| ● | Регенеративный твердотельный лазерный усилитель Spitfire | Spectra-Physics | 2004 |
| ● | Параметрический лазерный усилитель Topas-White. | Light Conversion | 2008 |
| ● | Амплитудно-фазовый лазерный модулятор SLM128 VIS. | CRI Inc. (PerkinElmer) | 2006 |
| ● | Амплитудно-фазовый лазерный модулятор SLM128 NIR. | CRI Inc. (PerkinElmer) | 2003 |
| ● | Амплитудно-фазовый лазерный модулятор SLM640 | JenOptik | 2020 |
| ● | Автокоррелятор моноимпульсный ASF-15. | Spectra-Physics | 2003 |
| ● | Измеритель амплитудно-фазовых параметров светового импульса SPIDER SP-120. | Avesta-Project | 2003 |
| ● | Спектрометр Spectra Star S100 | Solar | 2004 |
| ● | Спектрометр Avaspec-2048 | Avantes | 2003 |
| ● | Спектрометр Ocean Optics HR 4000 | Ocean Optics (Ocean Insight) | 2006 |
| ● | Полихроматор Acton SP300 | Roper Scientific | 2003 |
| ● | EMCCD камера Newton 970 | Andor (Teledyne) | 2006 |
| ● | Осциллограф цифровой Waverunner 6051A | Teledyne LeCroy | 2007 |
| ● | Лазерный измеритель мощности Spectra Physics Model 407A | Spectra-Physics | 2003 |
| ● | Лазерный измеритель малой мощности Thorlabs PM100USB/S302C | Thorlabs | 2014 |
| ● | Гальванические зеркала SC500 | Cambridge Technology | 2012 |
| ● | Фотоумножитель PMM02 | Thorlabs | 2012 |
| ● | Моторизированные устройства: подвижки, вращатели | Standa | 2014, 2016, 2018, 2020 |
| ● | Спектрограф-монохроматор MS350i | SOL Instruments | 2008, 2022 |
| ● | Измеритель длительности и фазы PulseCheck | APE | 2020 |
| ● | Модулятор частоты повторения импульсов PulseSelect | APE | 2020 |
| ● | Синхронный усилитель SR844 | Stanford Research Systems | 2020 |
| ● | Объективы PLAN APO NIR с большим рабочим расстоянием | Mitutoyo | 2016,2020, 2022 |
| ● | Спектрометр сканирующий ASP-IR | Авеста | 2020 |
| ● | Спектрограф MS520 | SOL Instruments | 2020 |
| ● | Параметрический двухканальный лазер Discovery NX | Coherent | 2020 |
| ● | Элементы оптических лазерных установок | Thorlabs, Edmund Optics, Standa, Newport, Specrogon | 2003-2022 |
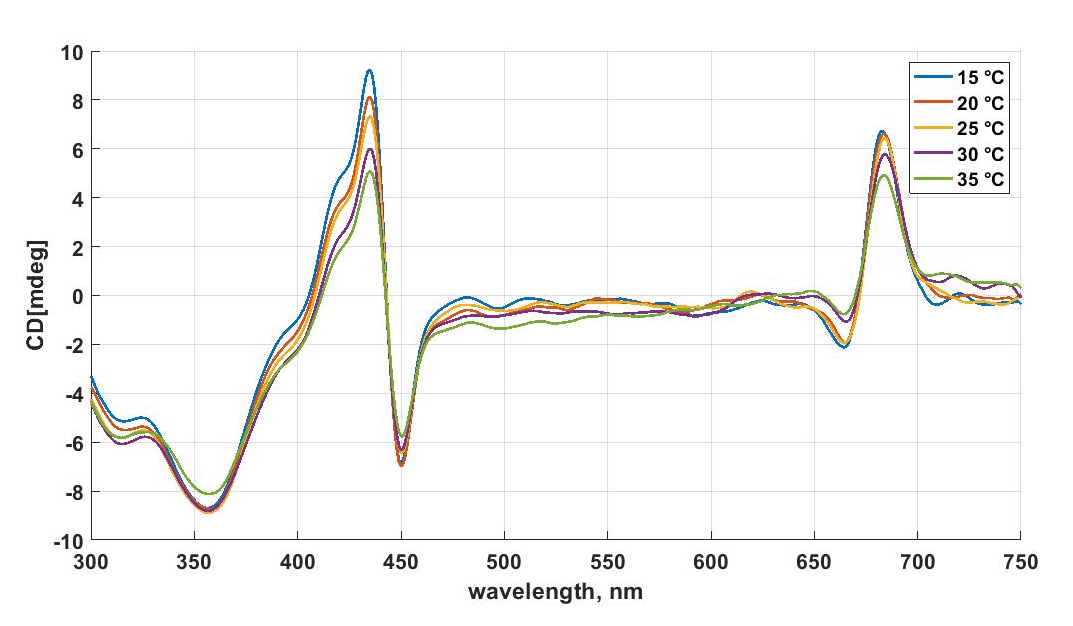
В направлении измерений абсорбционных свойств измеряется поглощение веществ и их оптическая активность (хиральность). Поглощение может быть измерено на всех трех представленных приборах: двухканальном спектрофотометре Shimadzu в широком диапазоне длин волн 200-3000 нм (жидкие образцы, пленки) - перепад поглощения может достигать более 4 Abs, используя круговой дихрограф (в диапазоне 190-900 нм, перепад поглощения может достигать ~2.5-3 Abs), или, используя волоконную систему Avantes. В последнем случае могут быть измерены жидкие образцы в кювете (в частности, в специализированной температурной кювете в диапазоне от -50 град до 70-80 град., в том числе в этом случае может быть измерена и флуоресценция), а также твердые сильно рассеивающие образцы с помощью интегрирующей сферы.
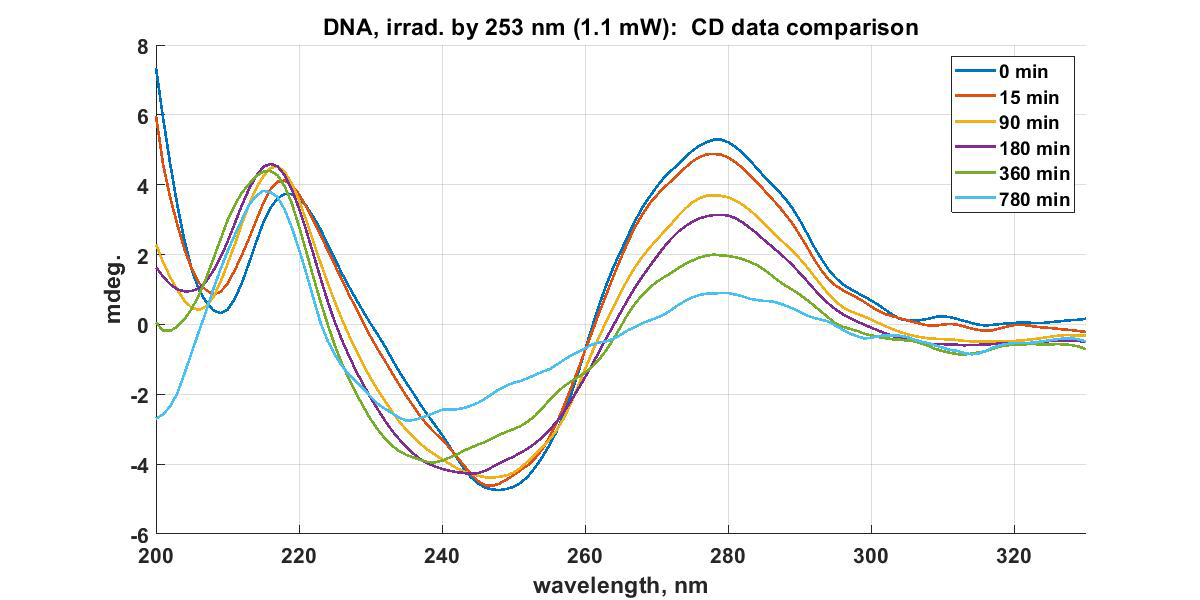
Оптическая активность измеряется через проявление кругового дихроизма веществами (ДНК, белки, взаимодействие пигментов и пр.) в диапазоне от 190 нм до 900 нм. Измерения проводятся в специализированных кюветах Hellma из кварцевого стекла без напряжений (Suprasil). Имеются кюветы разных конфигураций, в частности, позволяющие проводить измерения микрообъемов: кюветы из черного кварца (~50 микролитров, оптический путь 5 мм), составные кюветы в которых оптический путь составляет не более 100 микрон.
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Спектрофотометр UV-3600 (185-3300нм) | Shimadzu | 2006 |
| ● | Спектрометр кругового дихроизма J815 | JASCO | 2010 |
| ● | Спектрометр волоконный Avalight | Avantes | 2010 |
Данное направление представлено разнообразными методиками флуоресцентной спектроскопии/микроскопии и включает в себя стандартные измерения на спектрофлуориметрах (Shimadzu, Horiba) и спектрометрах (Avantes) УФ, видимого и БИК диапазонов (в т.ч. возможно проведении измерений в широком диапазоне температур). Возможны флуорецентные измерения при возбуждении разными лазерными источниками (высокомонохроматичными, импульсными) УФ, видимого и БИК диапазонов.
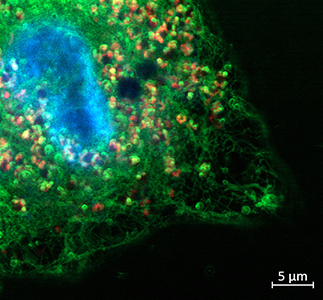
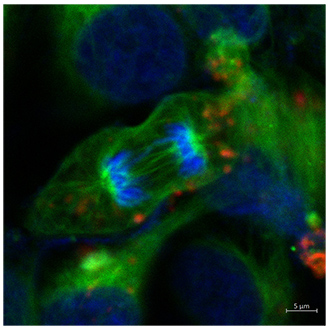
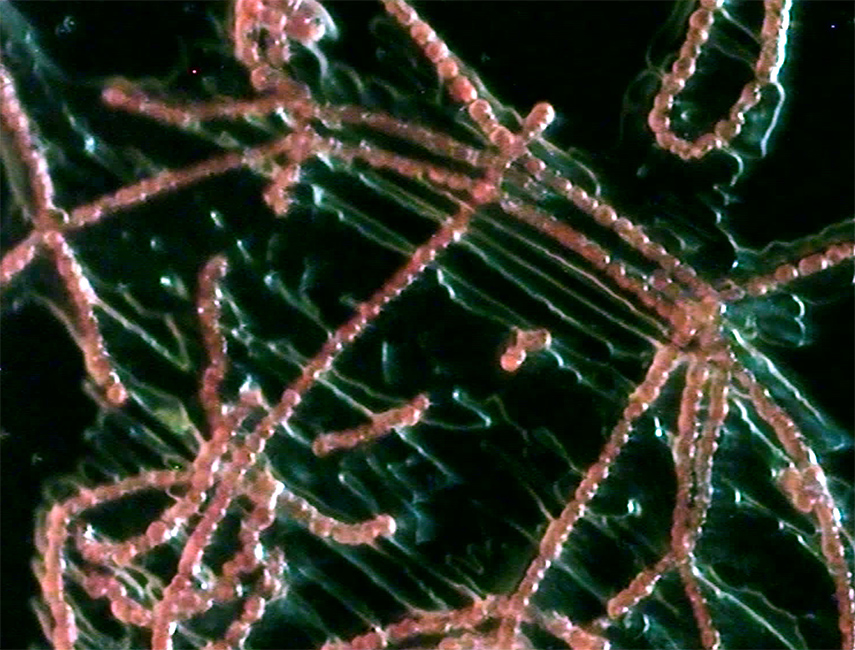
Комплекс микроскопии, с учетом кастомной конфигурации, имеющейся в ФИЦ ХФ РАН позволяет возбуждать образцы на длинах волн 405 нм, 488 нм, 561 нм, 639 нм, а также на длинах волн ИК диапазона для возбуждения двухфотонной флуоресценции (фемтосекундный лазер, длительность импульсов ~140 фс, частота повторения 80 МГц). Имеются разные сценарии проведения сканирования одной и той же области образца: 1) возбуждение производится одновременно несколькими лазерами и для каждого детектора (3 детектора) записывается сигнал соответствующего спектрального участка; 2) возбуждение производится последовательно: сначала область сканируется для возбуждения первым лазеров, потом для возбуждения вторым лазером и т.д., в данном случае сигнал может быть собран на один и тот же детектор. Имеется набор воздушных и иммерсионных (вода, масло) объективов, используемых в зависимости от задачи.
Основными конкретными научно-техническими задачами методики являются:
- Изучение флуоресцентных полимеров, композитных материалов, природных минералов, биологических образцов при однофотонном и многофотонном режимах возбуждения;
- Направленное создание и изучение эволюции углеродных флуоресцирующих наноточек в живых биологических объектах.
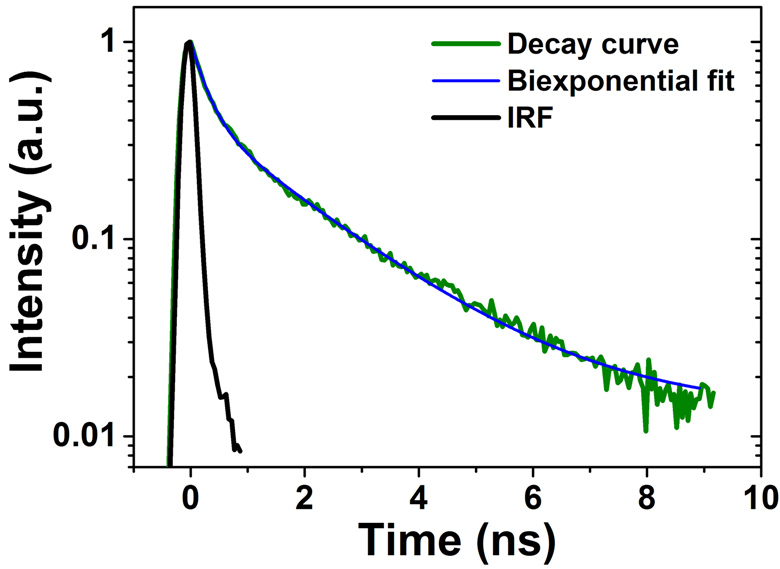
- Измерение временных характеристик флуоресценции (FLIM), в т.ч. поляризационные измерения.
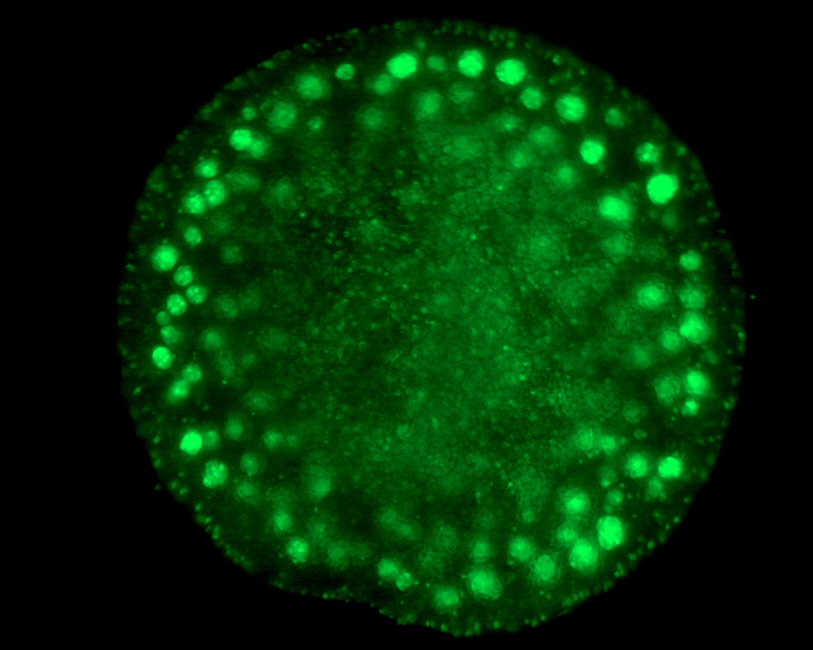
- Сверхбыстрый конфокальный имиджинг живых биологических объектов: одновременное возбуждение (при сканировании) разных флуорофоров несколькими лазерами, распределение флуорофоров. Изучение биологических образцов может проводиться in-vivo с использованием инкубатора микроскопа. Список объектов: ооциты млекопитающих, стволовые клетки (в общем случае любые окрашенные клетки и ткани под имеющиеся лазеры накачки), природные пигментные структуры (напр. листья растений, растворы хлорофилл-содержащих белков и др.), квантовые точки (изучение однородности тонких пленочных покрытий), эффект усиления флуоресценции плазмонными наноструктурами (Metal enhanced fluorescence, MEF).
Разработана уникальная установка на основе флуоресцентного микроскопа с возбуждением образца остросфокусированными фемтосекундными импульсами ближнего ИК диапазона с длиной волны от 690 нм до 920 нм и длительностью до 25 фс. Двухфотонная флуоресценция при воздействии фемтосекундного лазера происходит за счет нелинейного 2-х фотонного поглощения образцом и антистоксовой флуоресценцией в коротковолновом спектральном диапазоне по сравнению с длиной волны возбуждения. За счет нелинейного возбуждения сигнал флуоресценции сильно локализован в области перетяжки лазерного пучка, что позволяет проводить 3D картирование образца с высоким разрешением. Диапазон возбуждения лежит в окне прозрачности биологической ткани, глубина проникновения в ткань достигает нескольких миллиметров. Установка позволяет регистрировать спектры люминесценции, кинетику затухания люминесценции с временным разрешением 0.2 нс. В составе установки также имеются источники LED для возбуждения прямой флуоресценции с длинами волн источников 385/405/445/462 нм, а также камеры и наборы фильтров для съемки флуоресцентных изображений.
Основными конкретными научно-техническими задачами методики являются:
- Изучение флуоресцентных полимеров, композитных материалов, природных минералов, биологических образцов при однофотонном и многофотонном режимах возбуждения;
- Направленное создание и изучение эволюции углеродных флуоресцирующих наноточек в живых биологических объектах.
- Измерение временных характеристик флуоресценции (FLIM), в т.ч. поляризационные измерения.
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Спектрофлуориметр RF-5301PC (220-900 нм) | Shimadzu | 2005 |
| ● | Спектрофлуориметр FluoroMax-4 (до 1700 нм) | Horiba | 2021 |
| ● | Сканирующий лазерный многоцветный конфокальный флуоресцентный микроскоп LSM980 с модулем AiryScan-2 | Zeiss | 2021 |
| ● | Параметрический двухканальный лазер Discovery NX | Coherent | 2020 |
| ● | Система время-коррелированного счета фотонов SPC-150N | Becker & Hickl | 2020 |
| ● | Быстрый гибридный детектор одиночных фотонов HPM-100-06 | Becker & Hickl | 2020 |
| ● | Чувствительный гибридный детектор одиночных фотонов HPM-100-40 (120 ps, 250 - 720nm) | Becker & Hickl | 2020 |
| ● | Фотоэлектронный умножитель PMH-100-6 | Becker & Hickl | 2005 |
| ● | Модулятор частоты повторения импульсов PulseSelect | APE | 2020 |
| ● | Непрерывный лазер Millennia 6sJSPG (532 нм, 10 Вт) | Spectra-Physics | 2009 |
| ● | Фемтосекундный лазер Tsunami 3941-M1BB (2 Вт, 80 МГц, 25 фс, 690-920 нм) | Spectra-Physics | 2007 |
| ● | Микроскоп IX71 (инвертированный 0.1-1.4N.A., пьезопривод 100x100x50мкм) | Olympus | 2005 |
| ● | Система время-коррелированого счета фотонов SPC730 (до 0.2 нс) | Becker & Hickl | 2005 |
| ● | Спектроскопическая камера PI-MAX 2 (до 20 нс). | Princeton Instruments | 2005 |
| ● | Спектрограф SP300i. | Roper Scientific | 2003 |
| ● | Камера CCD 4070M-GE-TE (4 МПкс, ч/б, охлаждаемая). | Thorlabs | 2014 |
| ● | Камера CCD xiD MD061CU-SY (6МПкс, цветная). | Ximea | 2015 |
| ● | Камера CCD xiQ MQ013MG-ON (1.3МПкс, до 1000 к/с). | Ximea | 2016 |
| ● | Система время-коррелированного счета фотонов SPC-150N | Becker & Hickl | 2020 |
| ● | Быстрый гибридный детектор одиночных фотонов HPM-100-06 | Becker & Hickl | 2020 |
| ● | Чувствительный гибридный детектор одиночных фотонов HPM-100-40 (120 ps, 250 - 720nm) | Becker & Hickl | 2020 |
| ● | Фотоэлектронный умножитель PMH-100-6 | Becker & Hickl | 2005 |
| ● | Лазерный диод NDB7675 462 нм 1.4W для флуоресцентной подсветки | Nichia | 2018 |
| ● | Выделитель импульсов 50kHz 700-1000nm | Авеста | 2007 |
| ● | Элементы оптических лазерных установок | Thorlabs, Edmund Optics, Standa, Newport | 2003-2024 |
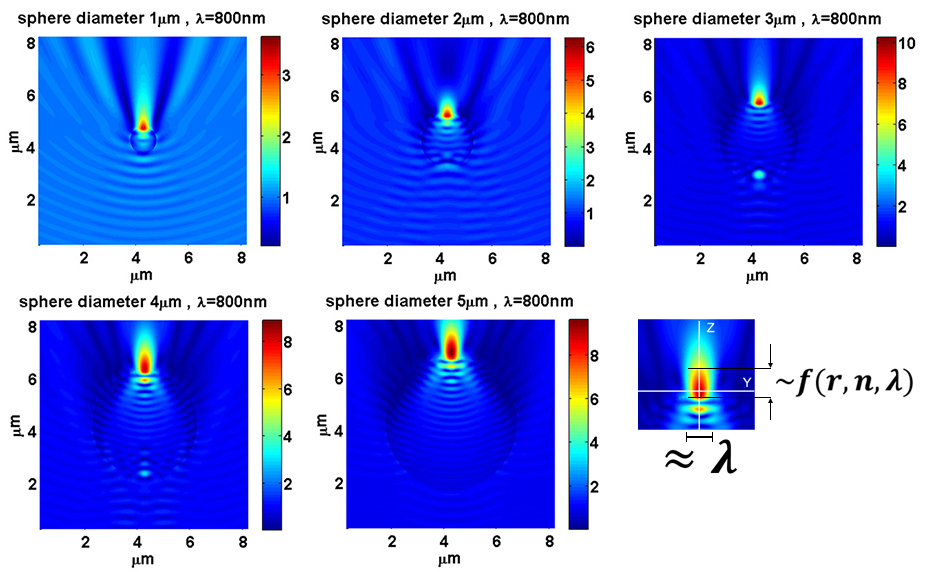
Данное направление исследований связано с воздействием импульсного лазерного излучения (фемтосекнудного) которое приводит к модификации физических, химических и биологических объектов. В центре (ЦКП) представлены фемтосекундные лазерные источники с различными спектральными и временными характеристиками, которые приводят к разнообразию эффектов воздействия фемтосекундного излучения. Для неживых систем тут решается, главным образом, две задачи: первая связана с микро/наноструктурированием непрозрачных и прозрачных материалов, генерации углеродных и плазмонных частиц в растворах. Вторая задача связана с более мягким режимом воздействия излучения, которая приводит к локальным температурным разогревам и плавлению материалов. Разработаны передовые методы и подходы для микро и нано-структурирования материалов с помощью фемтосекундных импульсов:
- Лазерное наноструктурирование поверхности и объема твердых тел с характерными размерами получаемых структур много меньше длины волны лазерного излучения. Наноструктурирование основано на использовании сильно локализованного высокоинтенсивного электромагнитно поля (ближнего поля), которое возникает при взаимодействии лазерных импульсов с диэлектрическими микросферами. Пространственное разрешение при структурировании составляет до 70 нм. Перемещение диэлектрических микросфер позволяет создавать сложные рельефы на поверхности структурируемого материала. Высокоточное перемещение микросфер достигается путем использования эффекта оптического захвата микрообъектов с помощью лазерного излучения.
- Автоматизированное 2D/3D лазерное фемтосекундное микро-структурирование материалов по заданному шаблону. Используемый при структурировании шаблон может описывать любую сложную конфигурацию: точечные и протяженные структуры в плоскости и объеме. Используемое оборудование позволяет получать структуры с размерами от микрона до нескольких сантиметров. В автоматизированной установке заложены гибкие возможности модификации энергии лазерного излучения, скорости перемещения по каждой из трех пространственных координат: данные параметры могут синхронно изменяться в процессе объемного структурирования. В частности, в случае прозрачных сред (силикатных, кварцевых и сапфировых стекол) подобное структурирование может быть сопряжено с последующим травлением материалов в специальных средах. Это позволяет получать в исходных заготовках отверстия и вырезы любых форм, протяженные каналы, сложные трафареты и матрицы. Получаемые образцы имеют очень широкий спектр применения для микрофильтрации и микрофлюидики.
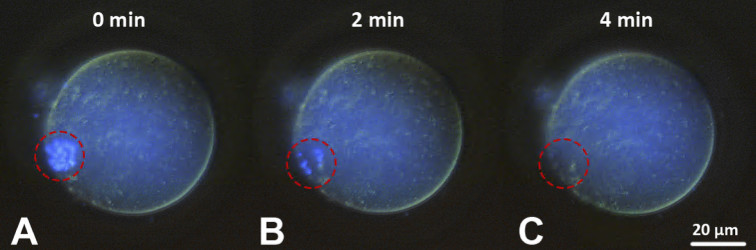
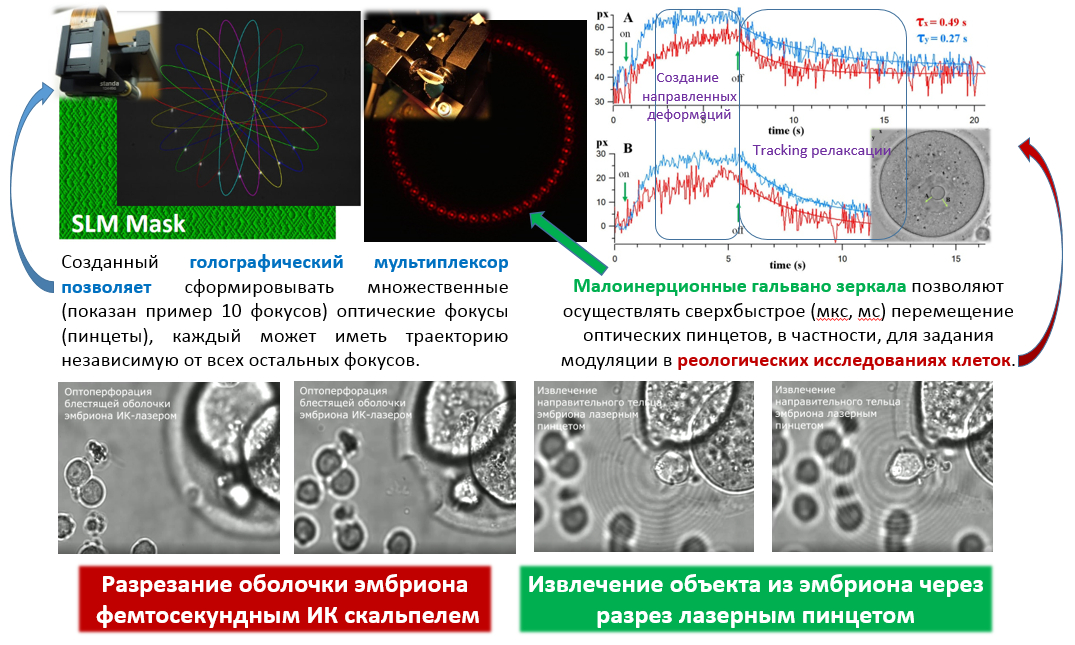
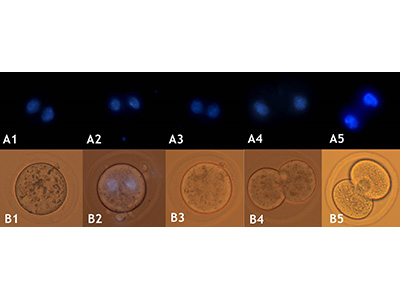
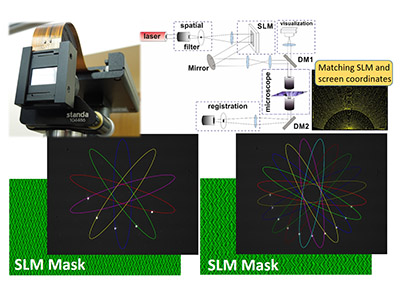
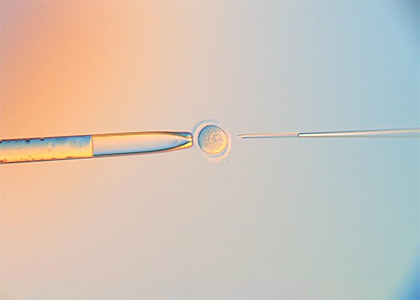
Изучение воздействия фемтосекундного лазерного излучения применительно к живым системам в последнее десятилетие выросло в отдельное направление называемое лазерной микро- и нанохирургией. В случае живых систем, для которых характерно движение объектов (в т.ч. движение внутри макрообъекта) здесь актуальными оказываются технологии удержания объектов в нужной точке пространства, перемещения объекта в нужную точку простраства, т.е. возможности захвата объекта. Речь может идти не только о механическом захвате (напр. с помощью микроманипуляторов, в т.ч. имеющихся в центре) но и лазерном захвате микро- нанообъектов, т.н. оптических пинцетах. В России наш центр стал первым (на рубеже нулевых и десятых годов), продемонстрировавший такие технологии. В дальнейшем в ЦКП была развита принципиально новая технология и разработано необходимое материально-техническое оснащение для проведения высокоэффективной минимально инвазивной нанохирургии эмбрионов млекопитающих с использованием фемтосекундных и непрерывных лазеров с излучением в ближнем ИК диапазоне в окне прозрачности биологической ткани. Разработана технология получения генетически модифицированных доимплантационных эмбрионов млекопитающих. В нашем центре была создана уникальная лазерная установка для проведения малоинвазивных микро- и нанохирургических операций и манипуляций с отдельными клетками, эмбрионами и тканями. Установка в себя включает: фемтосекундный лазер ближнего ИК диапазона; непрерывные лазеры видимого и ближнего ИК диапазона; оптический микроскоп с моторизованной 2D платформой; пространственные световые модуляторы света (SLM). Использование остросфокусированных фемтосекундных лазерных импульсов позволяет создавать микро- и наноразрезы в биологическом материале без теплового разогрева. Совместное использование непрерывного лазера и SLM позволяет получать сложные распределения электромагнитных полей в объеме образца, например, создавать множественные независимые лазерные фокусы. В частности, каждый из таких лазерных фокусов может представлять из себя оптическую ловушку для клеток или органелл клетки. При надлежащем выборе параметров эксперимента можно осуществлять удерживание, вращение или независимое перемещение данных объектов, в т.ч. растаскивание или сближение нескольких объектов одновременно (оптический мультиплексор). Это дает богатую информацию о силах между органеллами, упругих свойствах биологических образцов. Перечень задач, который позволяет решать данная установка следующий:
- Лазерная диссекция тканей и клеток.
- Оптическая трансфекция (введение внешнего генетического материала в клетки через созданные в клеточной мембране каналы).
- Лазерный хетчинг (надсечка и частичное удаление блестящей оболочки эмбриона для более эффективного выхода эмбриона).
- Искусственное лазерное слияние двух или более клеток.
- Лазерная инактивация хромосом клетки.
- Терапевтическое лазерное клонирование.
- Изучение упругих свойств биообъектов на разных этапах развития; сил взаимодействия между отдельными частями биологической системы (органеллами, органеллами и мембранами и др.).
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Непрерывный лазер Millennia 6sJSPG (532 нм, 10 Вт) | Spectra-Physics | 2009 |
| ● | Фемтосекундный лазер Tsunami 3941-M1BB (2 Вт, 80 МГц, 25 фс, 690-920 нм). | Spectra-Physics | 2007 |
| ● | Импульсный лазер Evolution X (527 нм, 10 Вт, 1 кГц, 150 нс). | Spectra-Physics | 2002 |
| ● | Многопроходный усилитель фемтосекундных импульсов (до 6 мкДж, 30 фс, 0-2000 Гц, 740-880 нм). | Avesta | 2005 |
| ● | Лазер непрерывный твердотельный с диодной накачкой Millennia pro 5sJ. | Spectra-Physics | 2007 |
| ● | Фемтосекундный лазер Tsunami 3060. | Spectra-Physics | 2003 |
| ● | Лазер импульсный твердотельный с диодной накачкой Empower. | Spectra-Physics | 2007 |
| ● | Регенеративный твердотельный лазерный усилитель Spitfire. | Spectra-Physics | 2004 |
| ● | Микроскоп IX71 (инвертированный 0.1-1.4N.A., пьезопривод 100x100x50мкм). | Olympus | 2005 |
| ● | Камера CCD xiD MD061CU-SY (6МПкс, цветная). | Ximea | 2015 |
| ● | Камера CCD xiQ MQ013MG-ON (1.3МПкс, до 1000 к/с) | Ximea | 2016 |
| ● | Моторизированные устройства: подвижки, врашатели | Standa | 2014-2020 |
| ● | Параметрический двухканальный лазер Discovery NX | Coherent | 2020 |
| ● | Одночастотный непрерывный лазер Verdi (532 нм, 8 Вт) | Coherent | 2003 |
| ● | Фемтосекундный лазер MaiTai (2,5 Вт, 80 МГц, 100 фс, 690-1100 нм). | Spectra-Physics | 2006 |
| ● | Непрерывный диодный лазер (1,48 мкм, 800 мВт). | Thorlabs | 2010 |
| ● | Титан-сапфировый непрерывный лазер (1,5 Вт, 750-850 нм). | Avesta Project | 2005 |
| ● | Пространственный оптический модулятор HEO 1080P. | Holoeye photonics AG | 2008 |
| ● | CMOS Камеры, цветная и ч\б (1,3 МПкс). | Thorlabs | 2011 |
| ● | Программируемый прерыватель пучка, SH05. | Thorlabs | 2011 |
| ● | Модулятор частоты повторения импульсов PulseSelect | APE | 2020 |
| ● | Элементы оптических лазерных установок | Thorlabs, Edmund Optics, Standa | 2003-2022 |
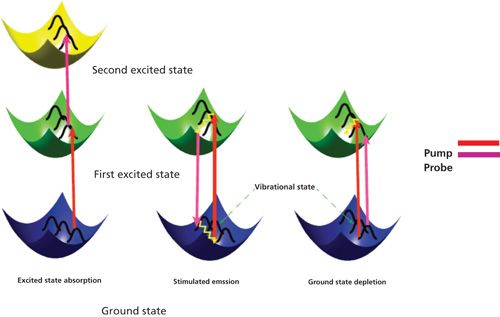
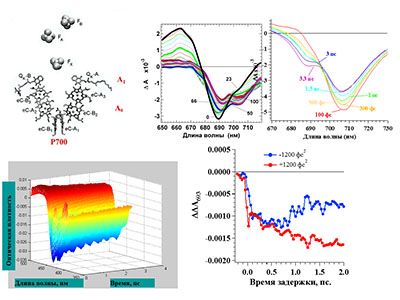
Уникальная установка фемтосекундной лазерной абсорбционной спектроскопии предназначена для исследования сверхбыстрых кинетических процессов в растворах, пленках, стеклах и т.п. В установке реализован метод «возбуждение-зондирование». Возбуждающий импульс переводит исследуемый образец в возбужденное состояние, динамика которого отслеживается по изменению поглощения зондирующего импульса в зависимости от временной задержки между возбуждающим и зондирующим импульсами. Максимально возможная задержка в эксперименте составляет 600 пс, минимальный шаг задержки равен 3.3 фс. Зондирующий импульс в результате генерации суперконтинуума имеет спектр в широком диапазоне: от 390 нм до 780 нм, что позволяет наблюдать кинетику изменения поглощения исследуемого образца сразу в широком спектральном окне.
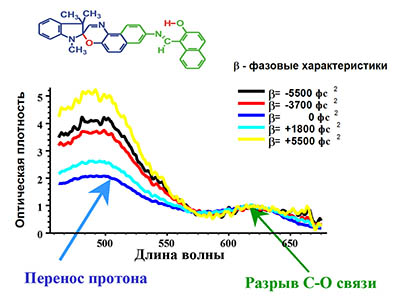
Для детального исследования сверхбыстрых кинетических процессов имеется возможность проведения экспериментов с различной поляризацией возбуждающего импульса, как с линейной, повернутой на любой угол относительно поляризации зондирующего излучения, так и циркулярной поляризацией возбуждающего импульса. Поляризационные исследования позволяют получить информацию об анизотропии поглощения объекта на самых ранних временах, дать информацию об изменении дипольного момента объекта, о переходах на другие ППЭ в процессе фотореакции.
Имеется возможность проводить фемтосекундные исследования с амплитудно-фазовой модуляцией возбуждающего лазерного излучения. Амплитудно-фазовая модуляция возбуждающего фемтосекундного импульса позволяет создавать самые разные начальные квантовые состояния, что влияет на дальнейшую фемто- и пикосекундную кинетику исследуемых объектов.
Для работы с растворами используется микронасос, который обеспечивает полную смену засвечиваемого объема образца между двумя фемтосекундными возбуждающими импульсами. Для биологических объектов используется микронасос с загрузкой в 1 мл образца, а для химических растворов - в 2 мл. Кроме того, предусмотрена возможность проведения измерений в условиях охлаждения или нагрева образца. В случае охлаждения возможно понижение температуры объекта вплоть до температур жидкого азота или гелия. В случае нагрева возможно повышение температуры объекта до 60 градусов Цельсия.
Таким образом, уникальная установка фемтосекундной лазерной абсорбционной спектроскопии позволяет:- Получить фемтосекундную динамику дифференциальных спектров образца до 600 пс с высоким временным разрешением в спектральном диапазоне 390-780 нм.
- Получить данные об анизотропии поглощения образца в фемтосекундом масштабе времени.
- Получить температурную зависимость фемтосекундной динамики образца (до температур жидкого азота или гелия).
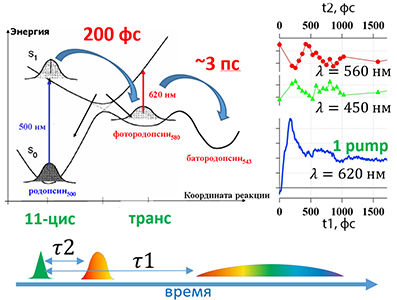
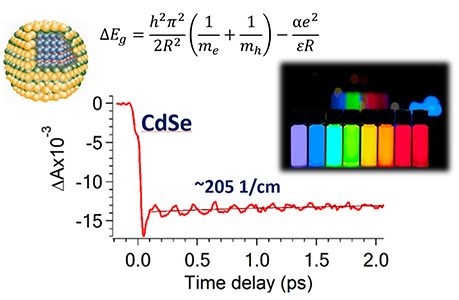
Основными конкретными научно-техническими задачами методики является исследование кинетики сверхбыстрых процессов (от десятков фемтосекунд до нескольких наносекунд) в химических и биологических системах (в том числе при низких температурах) в видимом спектральном диапазоне с фемтосекундным временным разрешением
- Фотосинтетических системах;
- Зрительных пигментах. Протонных и натриевых помпах.
- Квантовых точках (CdSe, CdTe, InP, InP/ZnS и др.).
- Гибридных нанокомпозитных (в т.ч. фотокаталитических) системах, в т.ч. с участием плазмонных наночастиц;
- Фуллеренах, углеродных нанотрубках.
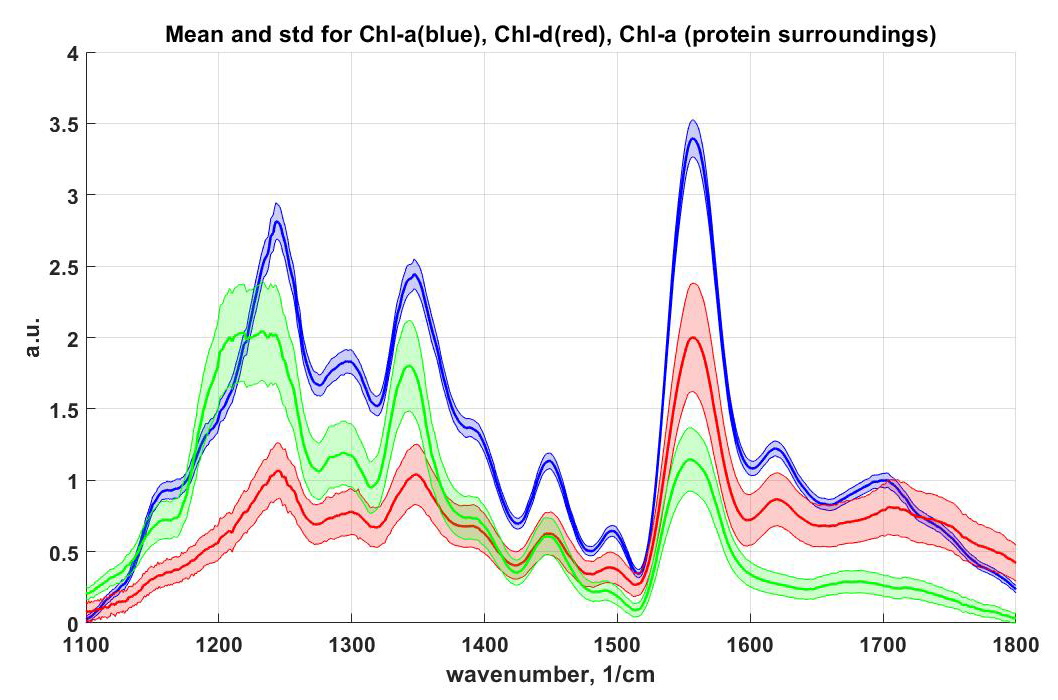
- Бифункциональных фотохромных соединениях с переносом заряда; макрогетероциклических соединениях (краун-соединениях), порфиринах, хлорофиллах, хлорофилл-содержащих белках.
Основное оборудование, которое входит в данное направление исследований:
| № | Название | Производитель | Год выпуска |
|---|---|---|---|
| ● | Лазер непрерывный твердотельный с диодной накачкой Millennia pro 5sJ | Spectra-Physics | 2007 |
| ● | Фемтосекундный лазер Tsunami 3060 | Spectra-Physics | 2003 |
| ● | Лазер импульсный твердотельный с диодной накачкой Empower | Spectra-Physics | 2007 |
| ● | Регенеративный твердотельный лазерный усилитель Spitfire | Spectra-Physics | 2004 |
| ● | Параметрический лазерный усилитель NOPA | Clark-MXR | 2003 |
| ● | Параметрический лазерный усилитель Topas-White | Light Conversion | 2008 |
| ● | Амплитудно-фазовый лазерный модулятор SLM128 VIS (DUAL) | CRI Inc. (PerkinElmer) | 2006 |
| ● | Амплитудно-фазовый лазерный модулятор SLM128 NIR (DUAL) | CRI Inc. (PerkinElmer) | 2003 |
| ● | Фазовый лазерный модулятор SLM128 VIS | CRI Inc. (PerkinElmer) | 2003 |
| ● | Автокоррелятор сканирующий Pulse Scout | Spectra-Physics | 2003 |
| ● | Автокоррелятор моноимпульсный ASF-15 | Avesta-Project | 2003 |
| ● | Измеритель амплитудно-фазовых параметров светового импульса SPIDER SP-120 | Avesta-Project | 2004 |
| ● | Спектрометр Spectra Star S100 | Solar | 2003 |
| ● | Спектрометр Avaspec-2048 | Avantes | 2006 |
| ● | Спектрометр Ocean Optics HR 4000 | Ocean Optics (Ocean Insight) | 2012 |
| ● | Полихроматор Acton SP300 | Roper Scientific | 2003 |
| ● | CCD камера Princeton Instruments Spec-10 | Roper Scientific | 2003 |
| ● | EMCCD камера Newton 970 | Andor (Teledyne) | 2006 |
| ● | Криостат ST-100 | JANIS | 2015 |
| ● | Вакуумный насос Hi CUBE | Pfeiffer | 2015 |
| ● | Сосуд Дьюара Nitrogen UN 1977 | CRYOFAB | 2015 |
| ● | Контроллер температуры Model 335 | LakeShore | 2015 |
| ● | Осциллограф цифровой Waverunner 6051A | Teledyne LeCroy | 2007 |
| ● | Микронасос MZR-7223 | Micropump | 2005 |
| ● | Лазерный измеритель мощности Spectra Physics Model 407A | Spectra-Physics | 2003 |
| ● | Лазерный измеритель малой мощности Thorlabs PM100USB/S302C | Thorlabs | 2014 |
| ● | Элементы оптических лазерных установок | Thorlabs, Edmund Optics, Standa, Newport, Specrogon | 2003-2022 |
По данному направлению возможны разнообразные работы с генетическим материалом лабораторных животных, работы по биотестированию проб водных растворов, различные виды пробоподготовки биохимических и биологических систем для методик спектроскопии, масс-спектрометрии.
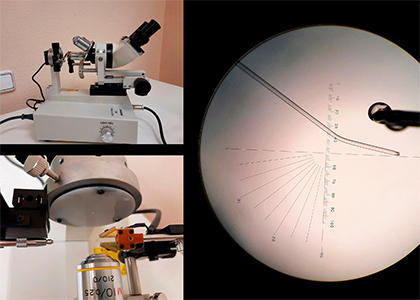
С лабораторными животными возможны следующие виды работ: работы по получению ооцитов (в т.ч. GV) и сперматозоидов лабораторных животных, культивирование ооцитов и доимплантационных эмбрионов лабораторных животных, партеногенетическая активация (диплоидная, на стадии MII) и последующее культивирование, слияние клеток, ИКСИ ооцитов лабораторных животных, биопсия бластомеров, полярного тельца, трофоэктодермы. Работы производятся с помощью микроманипулятора, которые широко распространены в сфере ЭКО. В экспериментах на животных микроманипулятор применяется для создания трансгенных животных путем инъекции генетического конструкта в пронуклеус яйцеклетки, для создания химерных животных и для множества других процедур, востребованных в различных исследованиях. Для иготовления микроинструментов манипулятора имеется специализированное оборудование: пуллер, микрокузница, гриндер (точильня).
Пуллер нагревает капилляр при помощи пружины, на которую подается напряжение, и затем растягивает его, позволяя получить тонкий кончик. Толщина этого кончика регулируется степенью нагрева и массой груза, выполняющего растяжение. Кончик толщиной с человеческий волос – около 80 микрон – используется для изготовления микроприсоски. Для ИКСИ нужен кончик толщиной до 10 микрон, а для инъекции в пронуклеус – 1-2 микрона.
Микрокузница используется для модификации профиля кончика капилляра. Главный элемент микрокузницы – нагреваемая платиновая проволока. При помощи этой проволоки осуществляются все манипуляции: кончик капилляра можно оплавить, можно обломить, согнуть, или создать на нем тонкий шип. Эти манипуляции проводятся под увеличением окуляров и объективов.
В состав гриндера входит мелкозернистый точильный круг с регулируемой скоростью вращения. Гриндер нужен для затачивания кончика капилляра, если требуется, чтобы срез был под углом – как, например, на микроиголке для ИКСИ. Самое сложное в работе с гриндером – уловить тот момент, когда кончик капилляра толщиной 10 микрон уже коснулся точильного камня. Чтобы изготовить микроприсоску, достаточно пуллера и микрокузницы. А для изготовления иголки для ИКСИ нужны все три прибора.
В центре также выполняются работы по биотестирование природных (пресная вода водных объектов, родников, колодцев, артезианских скважин, водопроводная вода) и сточных вод. Выполняется два вида биотестов:
- Биотест инфузория Tetrahymena pyriformis: по данным фотофиксации движущихся инфузорий в микро-аквариуме производится расчет токсичности пробы воды по ингибированию прироста инфузорий за 24 часа экспонирования в термостате при 25°С. ГОСТ Р 57166-2016;
- Биотест микроводоросли Chlorella: В рамках биотеста производится: а) Культивирование суспензии микроводоросли Chlorella при 36°С; б) Измерение оптической плотности суспензии микроводоросли Chlorella; в) Измерение флуоресценции суспензии микроводоросли Chlorella. Полученные данные используются для расчета токсичности пробы воды по ингибированию прироста микроводорослей за 20 часов экспонирования при 36°С по ПНД ФТ 16.1:2:2.2:2.3:3.7-04, ФР 1.39.2021 40209.
Основное оборудование, которое входит в данное направление исследований:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | Микрокузница | Narishige | 2022 |
| ● | Комплекс «БиоЛат 3.0» | ООО «Европолитест» | 2011 |
| ● | Культиваторы водоросли Хлорелла КВМ-05, КВ-0,5 | ООО «Европолитест» | 2020 |
| ● | Фотоколориметр КФК-3 | «ЗОМЗ» | 2020 |
| ● | Фотоколориметр «Флюорат» | «Люмекс» | 2020 |
В центре (ЦКП), в частности, выполняются работы, которые в настоящий момент не входят в отдельное направление. Сюда относятся и работы по измерениям, и общелаборной/общеинженерной направленности. К дополнительным работам по измерениям, а также общелабораторной направленности относятся: получение ЛИЭС (LIBS) спектров, детектирование элементов на жидкостном сцинтилляторе, измерения спектральных характеристик источников света в УФ/ видимом/БИК (до 2500 нм) диапазонах, облучение образцов источниками света различных длин волн, визуализация (фото и видеосъемка) объектов в дифференциально-интерференционном контрасте (DIC) и поляризованном свете, центрифугирование образцов (включая образцы больших объемов в специализированной центрифуге), заморозка и хранение образцов при температуре -86 град, выполнение расчетных работ по электродинамике (метод FDTD) и (относительно нересурсоемкой) квантовой химии (ORCA) на лабораторном кластере, выполнение хемометрического анализа данных с помощью разработанных алгоритмов.
К работам инженерной направленности относятся: печать пластиковых деталей на 3D принтере (есть разные виды пластиков), печать нержавеющей сталью на специализированном 3D принтере, разработка программного обеспечения, разработка устройств синхронизации между узлами экспериментальных комплексов, станочные работы по металлу.
Основное оборудование, которое входит в дополнительные возможности:
| Наименование | Производитель | Год выпуска | |
|---|---|---|---|
| ● | CO2 – инкубатор MCO-15AC | SANYO | 2004 |
| ● | CO2 – инкубатор MCO-18AC | SANYO | 2014 |
| ● | Микроцентрифуга Minispin Plus | Eppendorf | 2022 |
| ● | Cтереомикроскоп M80 | Leica | 2010 |
| ● | Ламинарный бокс ВЛ-12 (2 шт.) | CАМПО | 2008 |
| ● | Стереомикроскоп EMZ-8TRD | MEIJI TECHNO | 2002 |
| ● | Микроскоп инвертированный | OPTON | 2002 |
| ● | Стереомикроскоп SMZ18 для работы в проходящем и отраженном свете с диапазоном увеличений 7.5-270x | Nikon | 2020 |
| ● | Шкаф химический, вытяжной с гранитной столешницей | Simple-PRO | 2020 |
| ● | Поляризационный микроскоп на базе IX73P2F | Olympus | 2021 |
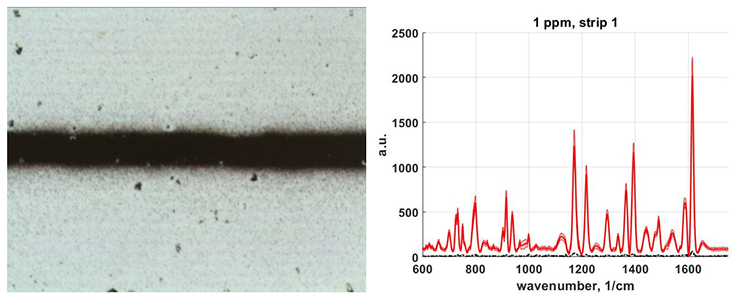
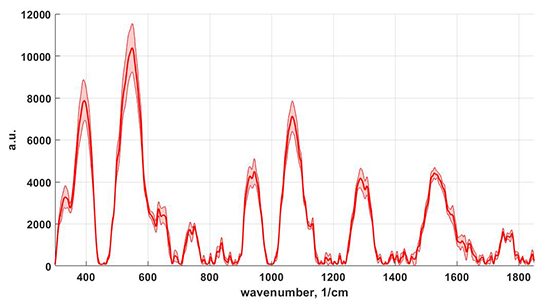
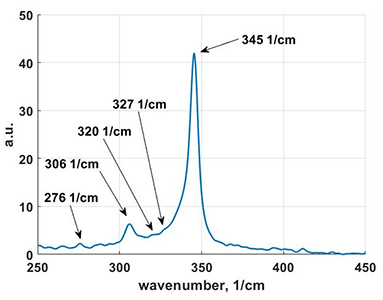
| ● | ЛИЭС микроспектрометр на базе New Wave Research Universal Platform | Ocean Optics (Ocean Insight) | 2009 |
| ● | Жидкостной Сцинтиллятор линейки Tri-carb | Perkin Elmer | 2009 |
| ● | Компьютерный кластер (i9 10700, более 100 ядер, память более 1 Tb) | Intel | 2021-2022 |
| ● | Низкотемпературные портативные морозильники | Global Cooling | 2019 |
| ● | 3D принтер по металлу 3DLAM Maxi | ЗАО «Биоград» | 2022 |
| ● | 3D-принтер Picaso Designer X S2 | PICASO3D | 2022 |